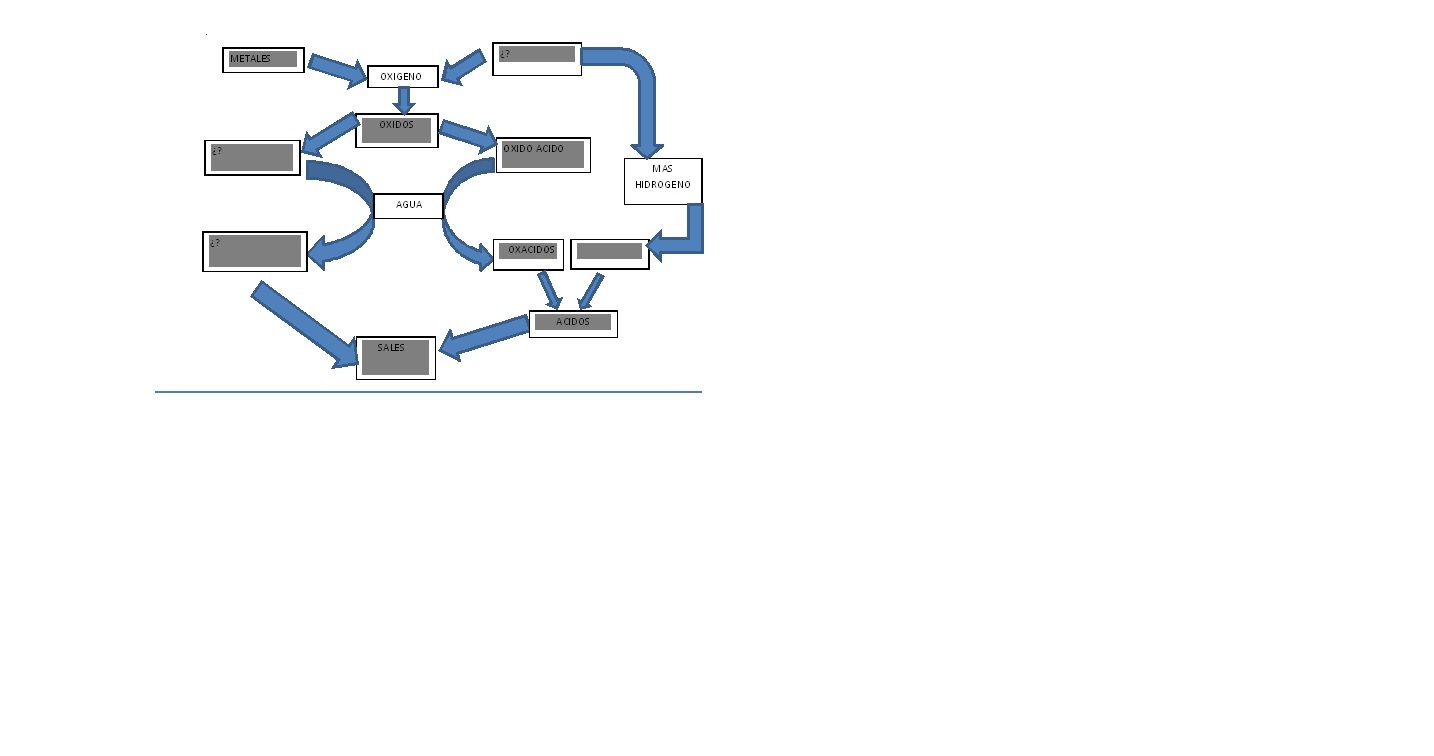
Desarrolle los siguientes ejercicios ( en hojas recicladas, impares para códigos impares, pares para LOS códigos pares)
NO OLVIDE BALANCEAR LAS ECUACIONES
1. En la siguiente reacción El monóxido de carbono reacciona con el oxígeno gaseoso para dar dióxido de carbono:
CO+ O2 -----------> CO2
Dentro de un recipiente cerrado se encuentran 100 g de CO y 40 g de O2 los cuales se necesitan para obtener C02. Determina el reactivo limitante y calcula el reactivo en exceso y la masa de CO2 que se obtiene.
2. En la siguiente reacción se determina la producción del cloruro de manganeso, se necesita conocer la producción de dicho compuesto cuando reaccionan 22g de MNO2 con 35g de HCl.
MnO2 + 4HCl -----------> MnCl2 + Cl2 + 2 H2O
3. Si Se hacen reaccionar 18,2 g de BaCl2 con 24,6 g de AgNO3 cuál es el reactivo límite, el reactivo en exceso y cuanto AgCl se obtiene de partiendo de la siguiente reacción.
AgNO3 + BaCl2 -----------> Ba(NO3)2 + AgCl
4. Se requiere conocer la cantidad de sulfato de calcio que se produce cuando reaccionan 900g de fosfato de calcio Ca3(PO4)2 con 600g de ácido sulfúrico H2SO4, no sin antes conocer el reactivo límite y el reactivo en exceso.
Ca3(PO4)2 + H2SO4 -----------> CaSO4 + Ca(H2PO4)2
5.Para obtener cloruro de plata se Haces reaccionar 42,6 g de nitrato de plata con 67 g de cloruro de aluminio para preparar cloruro de plata y nitrato de aluminio. ¿Cuál es el reactivo limitante, el reactivo en exceso y cuanto gramos de cloruro de plata se obtiene.
AgNO3 + AlCl3 -----------> AgCl + Al(NO3)3
6. El propano es un combustible que al reaccionar con oxígeno produce dióxido de carbono agua y energía por eso es empleado como combustible para cocinar los alimentos. Al hacer reaccionar 11,5 g de Propano con 48g de oxígeno. Cuál será la cantidad de dióxido de carbono que se produce.
C3H8 + O2 -----------> CO2 + H2O
7. Si reaccionan 5,2g de Fe con 11ml de ácido sulfúrico cuya densidad de dicho ácido es de 1,89g/ml. Cuál es el reactivo límite, el reactivo en exceso y Cuantos gramos de sulfato férrico se obtendrán. .
Fe + H2SO4------------> FeSO4 + H2
8. Teniendo en cuenta la siguiente ecuación.
Ca + H2O -----------> Ca(OH)2 + H2
Si reaccionan 25g al 90% de Ca con 20.5 cm3 de agua cuya densidad es de 1,00g/cm3 (D=m/V) Cuál es el reactivo límite, el reactivo en exceso y Cuantos gramos de hidróxido de calcio se obtendrán
9. Si se tienen 46g de HCl y 46g de NaOH, defina quien es el reactivo límite y el reactivo en exceso y cuantas moles de sal se obtendrán.
Cl2 + NaOH ---> NaCl + H2O
10. Si reaccionan 15 gramos de NaOH con 20 gramosde H₂SO₄, cual será el reactivo límite, el reactivo en exceso y las moles de sulfato de sodio que se producirán.
NaOH + H₂SO₄ -----------> Na₂SO₄ + H₂O